雖然賴氨酸甲基化在轉錄水平上對基因表達的調控作用是眾所周知的����,但其在蛋白質翻譯中的意義在很大程度上尚未被探索����。
雖然賴氨酸甲基化在轉錄水平上對基因表達的調控作用是眾所周知的,但其在蛋白質翻譯中的意義在很大程度上尚未被探索�����。
位于GTP酶激活中心的核心核糖體蛋白RPL40上第22位的賴氨酸(K22)的三甲基化(K22me3)在27年前就首次被報道了。然而���,其甲基轉移酶及在蛋白質翻譯中的作用尚不清楚����。
2024年8月5日�����,復旦大學附屬中山醫(yī)院藍斐���、蔡加彬團隊聯(lián)合德克薩斯大學MD安德森癌癥中心及諾華(中國)生物醫(yī)學研究中心�,在 Cell Research 期刊發(fā)表了題為:SMYD5 is a ribosomal methyltransferase that catalyzes RPL40 lysine methylation to enhance translation output and promote hepatocellular carcinoma 的研究論文���。
該研究表明���,SMYD5是一種核糖體甲基轉移酶,它能過催化RPL40的賴氨酸甲基化(RPL40 K22me3)���,以增強蛋白質翻譯輸出并促進肝細胞癌(HCC)。 這些研究結果揭示了SMYD5-RPL40 K22me3信號軸在翻譯延伸中的新作用����,并強調了在肝細胞癌中靶向SMYD5的治療潛力���,特別是同時抑制mTOR。這項工作還在概念上拓寬了對賴氨酸甲基化的理解���,將其意義從轉錄調控擴展到了翻譯控制���。
蛋白質賴氨酸Nε-甲基化在各種生物過程中發(fā)揮著至關重要的作用。在過去約二十年中���,雖然其通過組蛋白對轉錄調控的影響已得到廣泛研究��,但其在翻譯中的作用在很大程度上仍未被探索����。
據(jù)報道�,幾種哺乳動物核糖體蛋白(例如RPL4、RPL29�、RPL40和RPL36A)均含有賴氨酸甲基化。其中�����,RPL40是由UBA52基因編碼的一種特殊核糖體蛋白。
前體UBA52蛋白是一種128個氨基酸組成的融合蛋白�,包括一個N端的泛素模塊(76個 氨基酸)融合。去除泛素后�,成熟形式的RPL40長度為52個氨基酸,是在細胞質中組裝到60S核糖體亞基的最后成分之一�����,其在蛋白質合成中具有重要功能���。早在27年前�,通過大鼠肝臟的質譜分析鑒定出了RPL40上K22的三甲基化(RPL40 K22me3����,相當于 UBA52 K98me3),并在在近的高分辨率核糖體結構研究中得到了可視化����。然而,這種修飾在翻譯和核糖體功能中的作用仍不清楚�����。
SMYD蛋白質構成了一個進化上保守的賴氨酸甲基轉移酶亞家族�,其特征是一個被MYND結構域分割的催化SET結構域�。最近有報道稱SMYD5能催化病毒Tat蛋白的甲基化并參與HIV感染�,還能在啟動子處催化組蛋白H3K36me3并驅動肝細胞癌(HCC)的腫瘤發(fā)生����,不過下游機制尚不清楚。
事實上��,來自TCGA數(shù)據(jù)庫的數(shù)據(jù)表明���,在大多數(shù)癌癥類型中��,SMYD5的mRNA水平升高����,其中肝細胞癌(HCC)是最顯著的類型之一���。與此一致的是�,最近的兩項多組學研究發(fā)現(xiàn)�,肝細胞癌樣本中SMYD5的mRNA和蛋白質水平均顯著升高,且與不良臨床結果相關��。
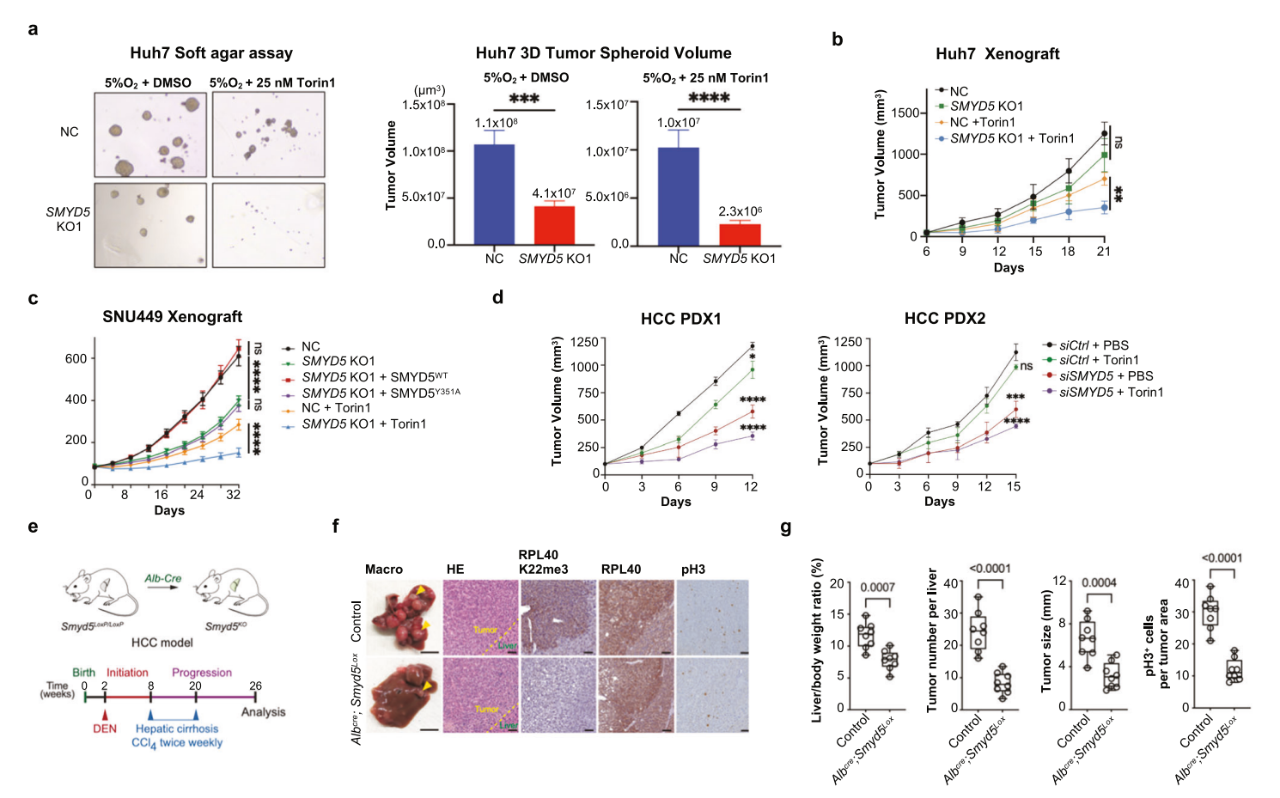
在這項最新研究中�����,研究團隊確定了SMYD5作為一種核糖體賴氨酸甲基轉移酶,其主要催化RPL40 K22me3�����。SMYD5-RPL40 K22me3信號軸對于有效的翻譯延伸和整體蛋白質合成至關重要�����。
在肝細胞癌(HCC)癌細胞 SMYD5的缺失會導致對mTOR抑制劑的超敏反應��,這可能是由于對蛋白質合成的復合抑制作用�。通過體外和體內肝細胞癌(HCC)模型,研究團隊進一步闡明了SMYD5介導的RPL40 K22me3在維持癌癥生長中的關鍵作用��,特別是在mTOR信號受到抑制的情況下�����。
具體來說�����,該研究顯示,SMYD5對RPL40 K22具有強大的體外活性�����,并且在細胞中主要催化 RPL40 K22me3���。SMYD5和RPL40 K22me3的缺失導致翻譯輸出減少和延伸受擾,SMYD5和RPL40 K22me3在肝細胞癌(HCC)中上調���,并且與患者預后呈負相關�。在2D和3D培養(yǎng)中���,敲除SMYD5使肝細胞癌細胞對mTOR抑制高度敏感�����。此外���,在基因工程小鼠和患者來源的異種移植(PDX)模型中,SMYD5的缺失顯著抑制 肝細胞癌的發(fā)展和生長����,在PDX模型中,同時抑制mTOR進一步增強了抑制效果。
這些發(fā)現(xiàn)強調了將SMYD5-RPL40 K22me3信號軸作為肝細胞癌患者的治療靶點的潛力���。
論文鏈接:
https://www.nature.com/articles/s41422-024-01013-3










![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博華國際展覽有限公司版權所有(保留一切權利)
滬ICP備05034851號-57
2006-2024 上海博華國際展覽有限公司版權所有(保留一切權利)
滬ICP備05034851號-57