傳遞遺傳信息到體內(nèi)目標(biāo)細(xì)胞內(nèi)部一直是基因治療面臨的主要挑戰(zhàn)。這一障礙現(xiàn)在正在被克服���,近年來(lái)�,基于脂質(zhì)的系統(tǒng)�����,特別是脂質(zhì)納米粒子(LNPs)����,在實(shí)現(xiàn)核酸疫苗和治療劑的遞送方面取得了顯著進(jìn)展。
傳遞遺傳信息到體內(nèi)目標(biāo)細(xì)胞內(nèi)部一直是基因治療面臨的主要挑戰(zhàn)����。這一障礙現(xiàn)在正在被克服,近年來(lái)����,基于脂質(zhì)的系統(tǒng)��,特別是脂質(zhì)納米粒子(LNPs)����,在實(shí)現(xiàn)核酸疫苗和治療劑的遞送方面取得了顯著進(jìn)展���。在這里我們基于脂質(zhì)納米粒子(LNPs)在核酸遞送中60年發(fā)展歷程�����,詳細(xì)介紹了脂質(zhì)體和脂質(zhì)復(fù)合物的發(fā)展�、脂質(zhì)納米粒子遞送系統(tǒng)的開發(fā)以及未來(lái)的展望����。
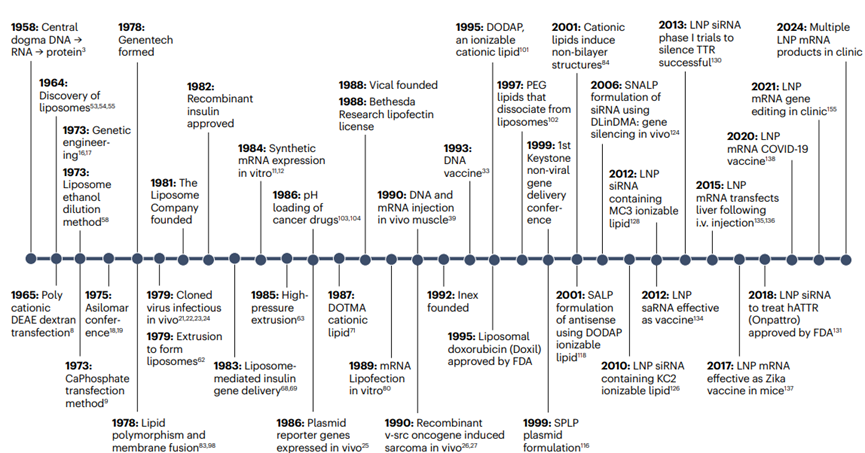
圖1.導(dǎo)致lnp激活RNA疫苗和療法的事件時(shí)間表
1958年,分子生物學(xué)的中心法則被提出��,即DNA到RNA再到蛋白質(zhì)的信息流����,這為后續(xù)的基因治療和RNA疫苗的發(fā)展奠定了理論基礎(chǔ);1964年到1973年期間�,脂質(zhì)體(liposomes)和鈣-磷酸鹽-DNA共沉淀法被發(fā)現(xiàn)�����,這為后續(xù)的LNP技術(shù)提供了技術(shù)原型���;1981年���,病毒載體進(jìn)行基因治療的概念被提出�����,這一概念對(duì)后續(xù)LNP技術(shù)的發(fā)展產(chǎn)生重要影響�����;1984年���,重組痘苗病毒的開發(fā)為RNA疫苗的發(fā)展提供了參考;1989年�����,一些非病毒方法被用于疫苗開發(fā)����;1990年代中期��,LNP技術(shù)發(fā)展進(jìn)入關(guān)鍵時(shí)期����,Inex Pharmaceuticals和UBC開始合作研究����,開發(fā)基于脂質(zhì)的核酸遞送系統(tǒng);1995年到1999年期間����,LNP技術(shù)中關(guān)鍵的脂質(zhì)成分離子化的可電離陽(yáng)離子脂質(zhì)DODAP穩(wěn)定質(zhì)粒脂質(zhì)體(SPLP)被開發(fā),標(biāo)志著LNP技術(shù)進(jìn)入新階段����。2001年到2012年期間,穩(wěn)定反義脂質(zhì)體(SALP)�����、穩(wěn)定核酸脂質(zhì)體(SNALP)配方和LNP siRNA相繼被開發(fā)出來(lái)����,使得LNP技術(shù)得到了進(jìn)一步發(fā)展���;2015年到2024年期間,LNP技術(shù)在mRNA遞送方面的發(fā)展及應(yīng)用�����,標(biāo)志著LNP技術(shù)在疫苗領(lǐng)域的成功應(yīng)用(圖1)��。LNP技術(shù)從早期的脂質(zhì)體研究到現(xiàn)代RNA疫苗和療法的60年的發(fā)展歷程�����,每一步都為最終的成功應(yīng)用奠定了基礎(chǔ)�。
脂質(zhì)體是在水中分散的脂質(zhì)形成的多層囊泡��,通常由一個(gè)或多個(gè)脂質(zhì)雙層組成�,這些雙層圍繞一個(gè)或多個(gè)水性腔室。脂質(zhì)雙層由兩排磷脂分子組成�,其中磷脂的親水性頭部朝向水相,而疏水性尾部相互面對(duì)��,形成穩(wěn)定的結(jié)構(gòu)����。同時(shí)��,為了提高脂質(zhì)體的循環(huán)時(shí)間和靶向性�����,脂質(zhì)體表面可以修飾聚乙二醇(PEG)等聚合物���,以減少免疫系統(tǒng)的識(shí)別和清除。由于脂質(zhì)體可以通過(guò)內(nèi)吞作用進(jìn)入細(xì)胞����,隨后在內(nèi)體或溶酶體中與膜融合,釋放其包裹的內(nèi)容物�。因此脂質(zhì)體可以作為藥物和基因治療劑的載體。脂質(zhì)體在藥物遞送和基因治療中起關(guān)鍵作用���,脂質(zhì)體的穩(wěn)定性�����、循環(huán)特性�、細(xì)胞攝取效率都會(huì)對(duì)最終的治療效果產(chǎn)生極大影響����。
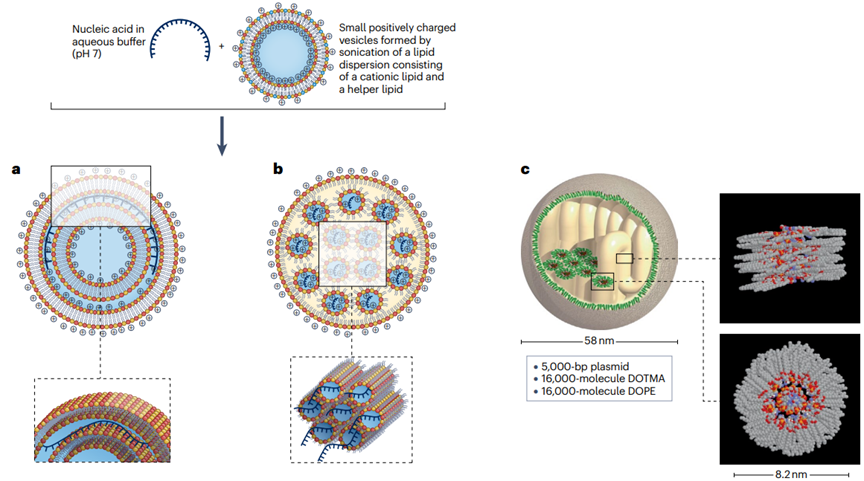
圖2.脂質(zhì)體的形成和結(jié)構(gòu)
脂質(zhì)納米顆粒(LNPs)的形成過(guò)程
LNP的形成是一個(gè)復(fù)雜的過(guò)程��,涉及精確的化學(xué)和物理操作�,以確保核酸的有效包裹和遞送��。這些顆粒的設(shè)計(jì)允許它們?cè)隗w內(nèi)循環(huán)��,特異性地靶向和進(jìn)入細(xì)胞����,最終釋放其核酸貨物,用于疫苗開發(fā)����、基因治療和其他治療應(yīng)用���。LNP由四種主要脂質(zhì)成分組成���,包括可電離脂質(zhì)(或陽(yáng)離子脂質(zhì))、輔助脂質(zhì)�、膽固醇和聚乙二醇化脂質(zhì)(PEG-脂質(zhì))。這些脂質(zhì)首先在有機(jī)溶劑(如乙醇)中溶解��,形成均勻的脂質(zhì)溶液���;之后將含有核酸(如mRNA)的水相溶液與脂質(zhì)的有機(jī)相溶液快速混合�。在混合過(guò)程中,可電離脂質(zhì)在水相中質(zhì)子化��,帶正電荷�����,與帶負(fù)電荷的核酸磷酸骨架發(fā)生靜電結(jié)合�。然后在混合后的溶液中,脂質(zhì)成分由于疏水作用和范德華力相互作用�,自發(fā)組織成納米結(jié)構(gòu)實(shí)體。這一過(guò)程中�����,脂質(zhì)成分圍繞核酸形成多層囊泡或納米結(jié)構(gòu)核心�。再然后通過(guò)改變PEG-脂質(zhì)的量或混合參數(shù)(如流速和體積比),調(diào)節(jié)LNP的大小和均勻性��。此外�,通過(guò)透析或切向流過(guò)濾提高pH值,中和可電離脂質(zhì)����,形成不帶電的納米脂質(zhì)顆粒�。最后通過(guò)擠壓�����、透析和過(guò)濾消毒等后處理步驟�,以確保LNP的均勻性、穩(wěn)定性���,并去除未封裝的貨物和多余的脂質(zhì)成分(圖3)���。LNP的形成過(guò)程對(duì)其最終的物理化學(xué)性質(zhì)和生物分布具有重要影響。例如�,LNP的大小、表面電荷(Zeta電位)����、包封效率和顆粒濃度等特性����,都會(huì)影響其在體內(nèi)的藥代動(dòng)力學(xué)和藥效學(xué)行為。因此����,優(yōu)化LNP的制備方法和配方組成�����,對(duì)于提高核酸藥物的遞送效率和治療效果至關(guān)重要��。
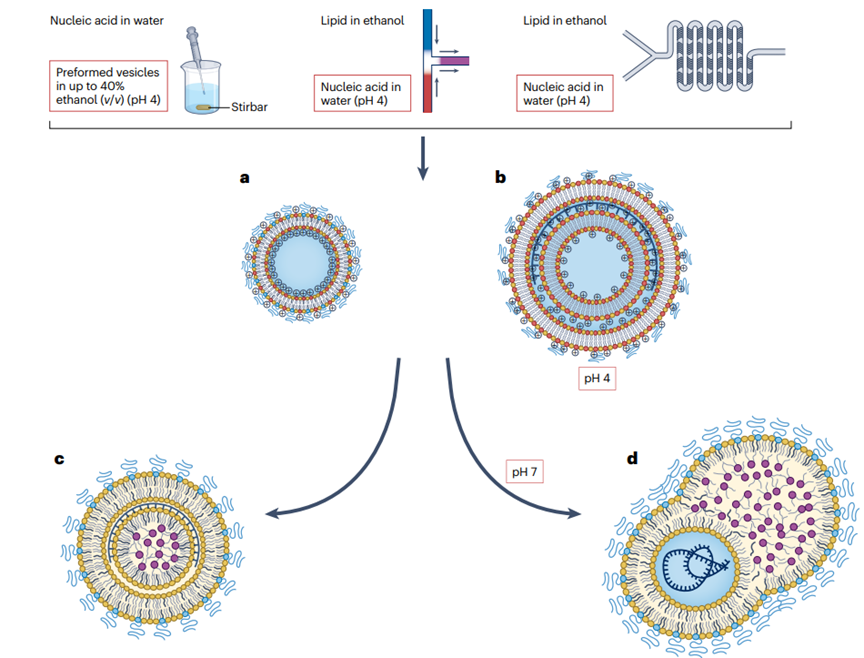
圖3.脂質(zhì)納米顆粒的形成
LNP mRNA傳遞系統(tǒng)的作用機(jī)制
脂質(zhì)納米粒(LNP)作為mRNA的傳遞系統(tǒng)����,其作用機(jī)制涉及多個(gè)步驟��,確保mRNA安全有效地遞送到目標(biāo)細(xì)胞并表達(dá)蛋白�����。首先LNP的脂質(zhì)外殼可以保護(hù)mRNA免受外界環(huán)境(如血液�����、組織液)中核酸酶的降解����,確保mRNA的穩(wěn)定性。LNPs會(huì)通過(guò)受體介導(dǎo)的內(nèi)吞作用被細(xì)胞攝取����,LNP被細(xì)胞攝取后����,會(huì)進(jìn)入內(nèi)涵體�����?���?呻婋x脂質(zhì)在內(nèi)涵體的酸性環(huán)境中質(zhì)子化,帶正電荷�,這有助于破壞內(nèi)涵體膜,使LNP能夠逃逸到細(xì)胞質(zhì)中���。內(nèi)涵體逃逸后����,mRNA從LNP中釋放出來(lái)����,進(jìn)入細(xì)胞質(zhì)�。釋放的mRNA在細(xì)胞質(zhì)中被核糖體識(shí)別并翻譯成相應(yīng)的蛋白質(zhì)���。翻譯后的蛋白質(zhì)在細(xì)胞內(nèi)或分泌到細(xì)胞外,發(fā)揮其生物學(xué)功能�����。LNP的脂質(zhì)成分在完成遞送任務(wù)后��,會(huì)在細(xì)胞內(nèi)逐漸被生物降解��,釋放出的成分可以被細(xì)胞再利用或排出體外(圖4)�����?�;谶@一作用機(jī)制LNPs在保護(hù)mRNA�����、促進(jìn)細(xì)胞內(nèi)傳遞���、以及激活免疫反應(yīng)方面發(fā)揮關(guān)鍵作用�����。
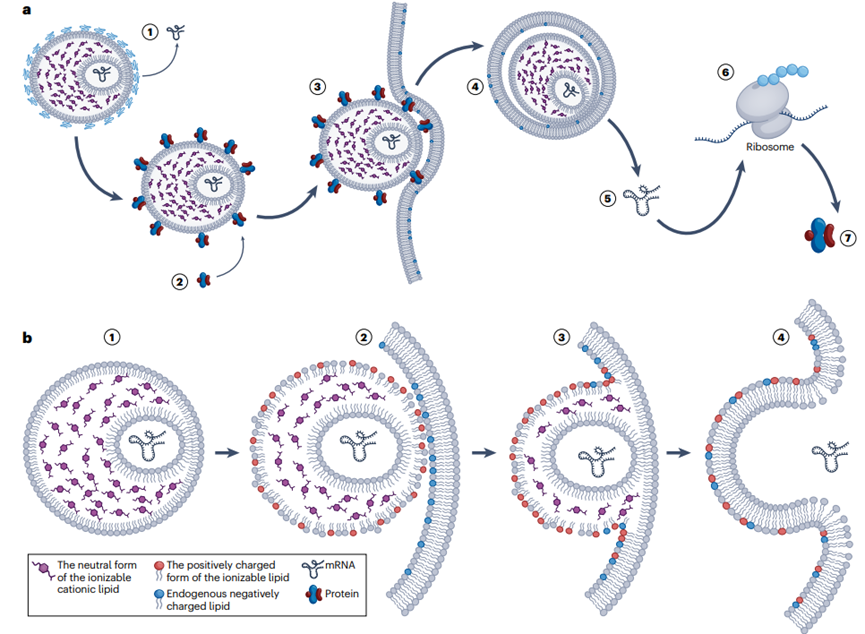
圖4.LNP mRNA傳遞系統(tǒng)的作用機(jī)制
當(dāng)前LNP技術(shù)的應(yīng)用
脂質(zhì)納米粒(LNP)技術(shù)作為一種先進(jìn)的藥物遞送系統(tǒng)�����,已經(jīng)在多個(gè)領(lǐng)域顯示出其廣泛的應(yīng)用潛力�。LNP技術(shù)在COVID-19 mRNA疫苗的開發(fā)中發(fā)揮了關(guān)鍵作用,成功實(shí)現(xiàn)了mRNA的高效遞送至人體細(xì)胞內(nèi)���,激發(fā)免疫反應(yīng)���,目前有60多種使用LNP遞送技術(shù)的疫苗和治療劑已經(jīng)獲得批準(zhǔn)或正在進(jìn)行臨床開發(fā),其中30種已經(jīng)進(jìn)展到超過(guò)第一階段的臨床試驗(yàn)(圖5)��。此外運(yùn)用LNP來(lái)封裝siRNA或mRNA��,可以實(shí)現(xiàn)對(duì)腫瘤組織的靶向性藥物遞送��,從而實(shí)現(xiàn)對(duì)癌癥的治療����。通過(guò)將Cas9 mRNA和sgRNA封裝在LNP中,也可實(shí)現(xiàn)對(duì)特定基因的精確編輯��。LNP也能夠作為蛋白質(zhì)替代療法遞送編碼治療性蛋白的mRNA����,用于治療由蛋白質(zhì)缺陷引起的遺傳性疾病。針對(duì)一些罕見遺傳病�����,LNP技術(shù)可以封裝特定的基因編輯組件或治療性mRNA���,為這些疾病提供潛在的治療方案等�����。LNP技術(shù)的多功能性和適應(yīng)性使其在生物醫(yī)學(xué)領(lǐng)域具有廣泛的應(yīng)用前景��,隨著研究的深入和技術(shù)的優(yōu)化��,預(yù)計(jì)將有更多的基于LNP遞送的核酸藥物上市��,為多種疾病提供新的治療策略����。
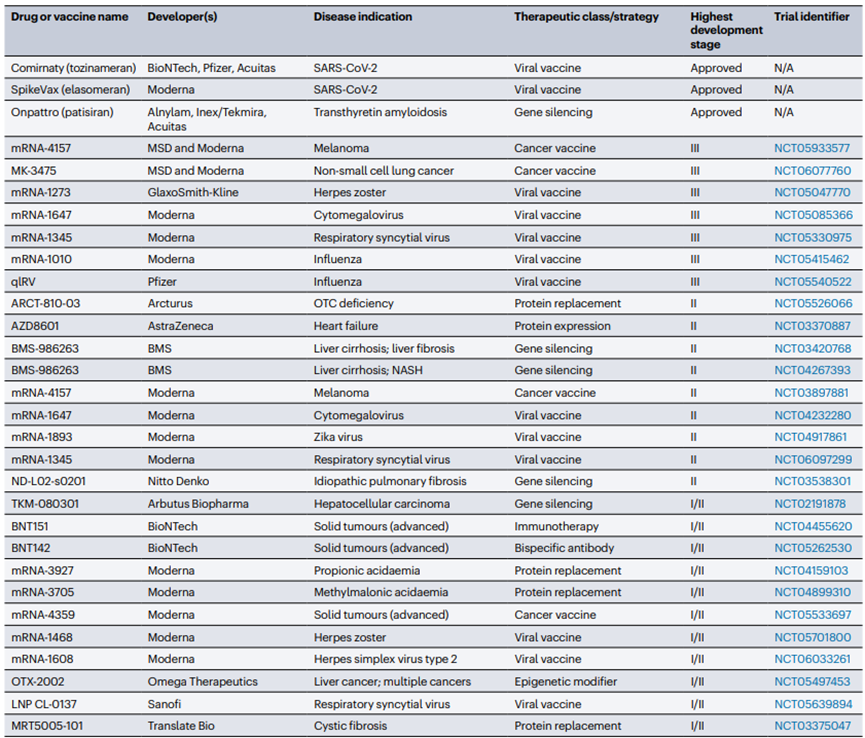
圖5.選定的lnp激活RNA疫苗和治療方法已超過(guò)I期臨床開發(fā)
寫在最后
總的來(lái)說(shuō)�,基于LNP的系統(tǒng)在核酸疫苗和治療劑遞送方面的顯著成功正在引領(lǐng)新一代基因治療的到來(lái)。這些系統(tǒng)在遺傳容量��、重新劑量能力、可擴(kuò)展性��、制造簡(jiǎn)易性����、成本低廉以及開發(fā)高度個(gè)性化的靶向治療方面,展現(xiàn)出了超越病毒和其他遞送系統(tǒng)的壓倒性優(yōu)勢(shì)�。基于LNP遞送系統(tǒng)啟用的基因治療的未來(lái)前景顯然是變革性的���。
參考文獻(xiàn):
The 60-year evolution of lipid nanoparticles for nucleic acid delivery














![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博華國(guó)際展覽有限公司版權(quán)所有(保留一切權(quán)利)
滬ICP備05034851號(hào)-57
2006-2024 上海博華國(guó)際展覽有限公司版權(quán)所有(保留一切權(quán)利)
滬ICP備05034851號(hào)-57