Nature子刊:清華大學(xué)藍(lán)勛/李寅青/朱明團(tuán)隊(duì)開(kāi)發(fā)通用型基因編輯脫靶檢測(cè)技術(shù)
近年來(lái)����,隨著諸如胞嘧啶堿基編輯器(CBE)�����、腺嘌呤堿基編輯器(ABE)和先導(dǎo)編輯器?(prime editor, PE)等新型基因編輯工具不斷被開(kāi)發(fā)�,CRISPR-Cas系統(tǒng)引領(lǐng)的基因編輯技術(shù)在眾多領(lǐng)域展現(xiàn)了巨大的應(yīng)用潛力���。然而�,脫靶效應(yīng)——即在預(yù)期目標(biāo)之外產(chǎn)生的編輯——不僅影響了生物學(xué)研究的準(zhǔn)確性���,也給基因治療的臨床應(yīng)用帶來(lái)了潛在的安全隱患。2023年美國(guó)FDA在審查首個(gè)CRISPR基因編輯療法的上市申請(qǐng)時(shí)�,風(fēng)險(xiǎn)評(píng)估���,尤其是脫靶效應(yīng)是其關(guān)注焦點(diǎn)�����。高效且精準(zhǔn)地檢測(cè)脫靶效應(yīng)成為了基因編輯技術(shù)的關(guān)鍵挑戰(zhàn)之一��。
近年來(lái),隨著諸如胞嘧啶堿基編輯器(CBE)��、腺嘌呤堿基編輯器(ABE)和先導(dǎo)編輯器 (prime editor, PE)等新型基因編輯工具不斷被開(kāi)發(fā)�����,CRISPR-Cas系統(tǒng)引領(lǐng)的基因編輯技術(shù)在眾多領(lǐng)域展現(xiàn)了巨大的應(yīng)用潛力�����。然而�����,脫靶效應(yīng)——即在預(yù)期目標(biāo)之外產(chǎn)生的編輯——不僅影響了生物學(xué)研究的準(zhǔn)確性�,也給基因治療的臨床應(yīng)用帶來(lái)了潛在的安全隱患����。2023年美國(guó)FDA在審查首個(gè)CRISPR基因編輯療法的上市申請(qǐng)時(shí),風(fēng)險(xiǎn)評(píng)估��,尤其是脫靶效應(yīng)是其關(guān)注焦點(diǎn)�����。高效且精準(zhǔn)地檢測(cè)脫靶效應(yīng)成為了基因編輯技術(shù)的關(guān)鍵挑戰(zhàn)之一���。
為應(yīng)對(duì)脫靶挑戰(zhàn)�,科學(xué)界提出了多種檢測(cè)方法����,包括基于生物信息學(xué)的預(yù)測(cè)��、生物化學(xué)檢測(cè)和細(xì)胞水平檢測(cè)方法。然而現(xiàn)存方法普適性較低����,或僅針對(duì)有限的編輯系統(tǒng)或細(xì)胞類型設(shè)計(jì),并且大多數(shù)方法無(wú)法應(yīng)用于離體及體內(nèi)編輯時(shí)的脫靶檢測(cè)����。
2024年7月2日17時(shí)�,清華大學(xué)醫(yī)學(xué)院藍(lán)勛團(tuán)隊(duì)與藥學(xué)院李寅青團(tuán)隊(duì)合作,在 Nature Biotechnology 期刊上發(fā)表了題為:Tracking-seq reveals the heterogeneity of off-target effects in CRISPR/Cas9-mediated genome editing 的研究論文�����。
該研究報(bào)道了一項(xiàng)名為Tracking-seq的新型脫靶效應(yīng)檢測(cè)技術(shù)�,并借助該技術(shù)揭示了不同細(xì)胞類型�����、不同編輯工具間存在的脫靶效應(yīng)異質(zhì)性��。該研究將為基因編輯在基因治療等領(lǐng)域的安全應(yīng)用提供重要理論參考及技術(shù)支持����。
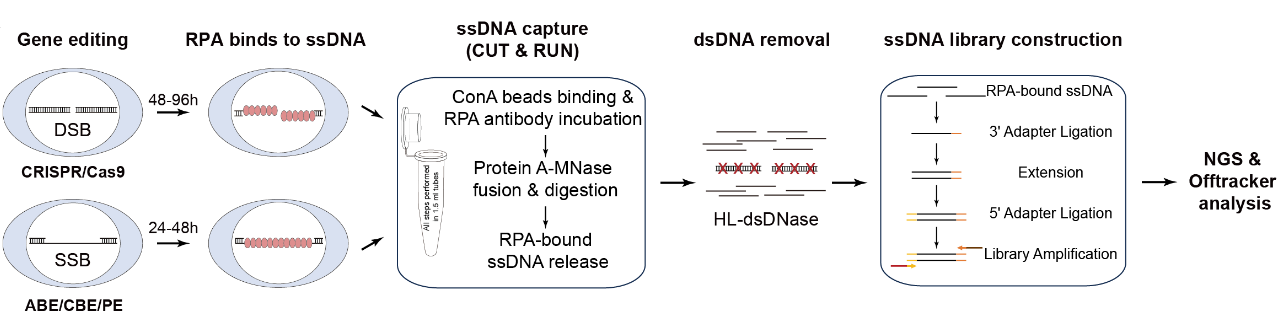
目前的主流基因編輯器均依賴于DNA損傷后的修復(fù)過(guò)程實(shí)現(xiàn)基因編輯�,復(fù)制蛋白A(replication protein A,RPA)廣泛存在于基因組雙鏈及單鏈損傷修復(fù)過(guò)程�,Tracking-seq通過(guò)CUT&RUN技術(shù)特異性地識(shí)別并捕獲與RPA結(jié)合的單鏈DNA(Single-stranded DNA��,ssDNA)�����,隨后利用鏈特異性核酸酶消化雙鏈DNA以提高信噪比����,構(gòu)建鏈特異性ssDNA文庫(kù)進(jìn)行高通量測(cè)序,并通過(guò)新開(kāi)發(fā)的算法精確計(jì)算RPA信號(hào)強(qiáng)度�,進(jìn)而實(shí)現(xiàn)對(duì)多種編輯工具的脫靶檢測(cè)����。
圖1. Tracking-seq示意圖
相較于現(xiàn)有的GUIDE-seq和DISCOVER-seq等脫靶檢測(cè)技術(shù),Tracking-seq不僅展現(xiàn)了高召回率�����,而且具備很高的檢測(cè)精確度��。重要的是�,其具有高度的泛用性���,使其能夠適用于Cas9、CBE�、ABE以及PE等各類主流基因編輯工具,并能適應(yīng)不同的細(xì)胞類型及不同的編輯環(huán)境(包括體外����、離體及體內(nèi)編輯)�����。此外�,Tracking-seq的高靈敏度使其能夠在僅有數(shù)千個(gè)細(xì)胞的樣品中�,有效地進(jìn)行脫靶檢測(cè),并保持優(yōu)異的結(jié)果��。
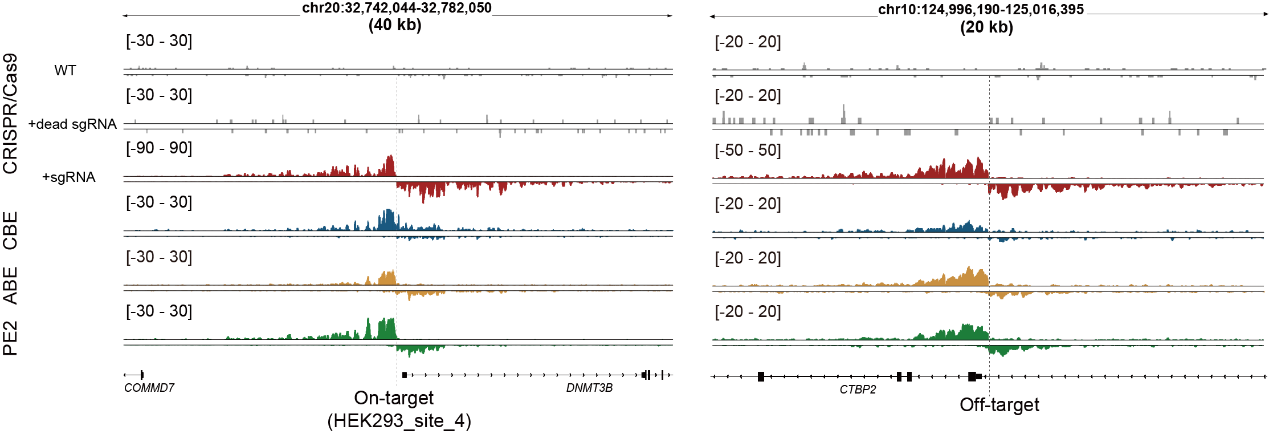
圖2. Tracking-seq檢測(cè)不同編輯工具的鏈特異性信號(hào)
得益于Tracking-seq的高泛用性,該研究發(fā)現(xiàn)當(dāng)使用相同的向?qū)NA時(shí)���,Cas9���、CBE、ABE和PE的脫靶效應(yīng)存在明顯差異�,其中Cas9和CBE之間觀測(cè)到了許多近似于各自特異的脫靶位點(diǎn)。此外��,不同類型的細(xì)胞中也觀察到了脫靶效應(yīng)的異質(zhì)性�,脫靶事件似乎更容易在染色質(zhì)開(kāi)放和活躍的區(qū)域發(fā)生。這些脫靶效應(yīng)的異質(zhì)性提示����,使用替代性編輯系統(tǒng)或在不同細(xì)胞類型中進(jìn)行的脫靶檢測(cè)���,可能無(wú)法準(zhǔn)確反映目標(biāo)細(xì)胞中實(shí)際的脫靶情況����。相比之下�����,Tracking-seq技術(shù)能夠直接對(duì)原始編輯系統(tǒng)進(jìn)行脫靶檢測(cè)��,因此具有廣闊的應(yīng)用潛力和前景���。











![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博華國(guó)際展覽有限公司版權(quán)所有(保留一切權(quán)利)
滬ICP備05034851號(hào)-57
2006-2024 上海博華國(guó)際展覽有限公司版權(quán)所有(保留一切權(quán)利)
滬ICP備05034851號(hào)-57