研究表明����,一種存在于早期胚胎中的能性和再生干細(xì)胞——原始內(nèi)胚層(Primitive Endoderm��,PrE)���,可以在分離后自行產(chǎn)生胚胎�����,這一突破性發(fā)現(xiàn)或?qū)⒊蔀橹委熑祟?lèi)不孕不育的關(guān)鍵��,有助于開(kāi)發(fā)出更成功的“試管嬰兒”等生育治療方式�����。
繁衍生育�,是自然界生物的本性之一�。事實(shí)上,受孕是一個(gè)非常復(fù)雜的過(guò)程�����。首先���,精子必須在輸卵管處與卵子完成受精作用��,然后受精卵開(kāi)始分裂��,大約五天后�����,受精卵變成囊胚并植入子宮���,并最終發(fā)育成胎兒。
然而��,現(xiàn)在隨著環(huán)境污染����、作息紊亂和生活壓力的增加等因素,精子和卵子的質(zhì)量受到各種因素的影響,自然生育正在變得越來(lái)越困難���。因此�����,越來(lái)越多的人不得不尋求輔助生育治療的幫助�����,但治療的成功率仍然很低�,僅為20%-30%����,并且具體取決于女性的年齡和生育能力。
近日���,丹麥哥本哈根大學(xué)的研究團(tuán)隊(duì)在 Cell 期刊發(fā)表了題為:The primitive endoderm supports lineage plasticity to enable regulative development(原始內(nèi)胚層支持譜系可塑性����,使調(diào)控發(fā)育成為可能)的研究論文��。
該研究表明��,一種存在于早期胚胎中的能性和再生干細(xì)胞——原始內(nèi)胚層(Primitive Endoderm,PrE)����,可以在分離后自行產(chǎn)生胚胎����,這一突破性發(fā)現(xiàn)或?qū)⒊蔀橹委熑祟?lèi)不孕不育的關(guān)鍵,有助于開(kāi)發(fā)出更成功的“試管嬰兒”等生育治療方式����。
早期胚胎中的細(xì)胞具有適應(yīng)和調(diào)節(jié)其命運(yùn)以應(yīng)對(duì)擾動(dòng)的非凡能力��,這種特征被稱(chēng)為可塑性��,使細(xì)胞能夠改變其分化軌跡����,是發(fā)育調(diào)控的重要標(biāo)志。此前的研究發(fā)現(xiàn)����,在小鼠胚胎中,2細(xì)胞階段的卵裂球在分離后能獨(dú)自發(fā)育成完整個(gè)體��,但此后隨著發(fā)育的進(jìn)行,每個(gè)卵裂球的發(fā)育潛力逐漸受到限制����。
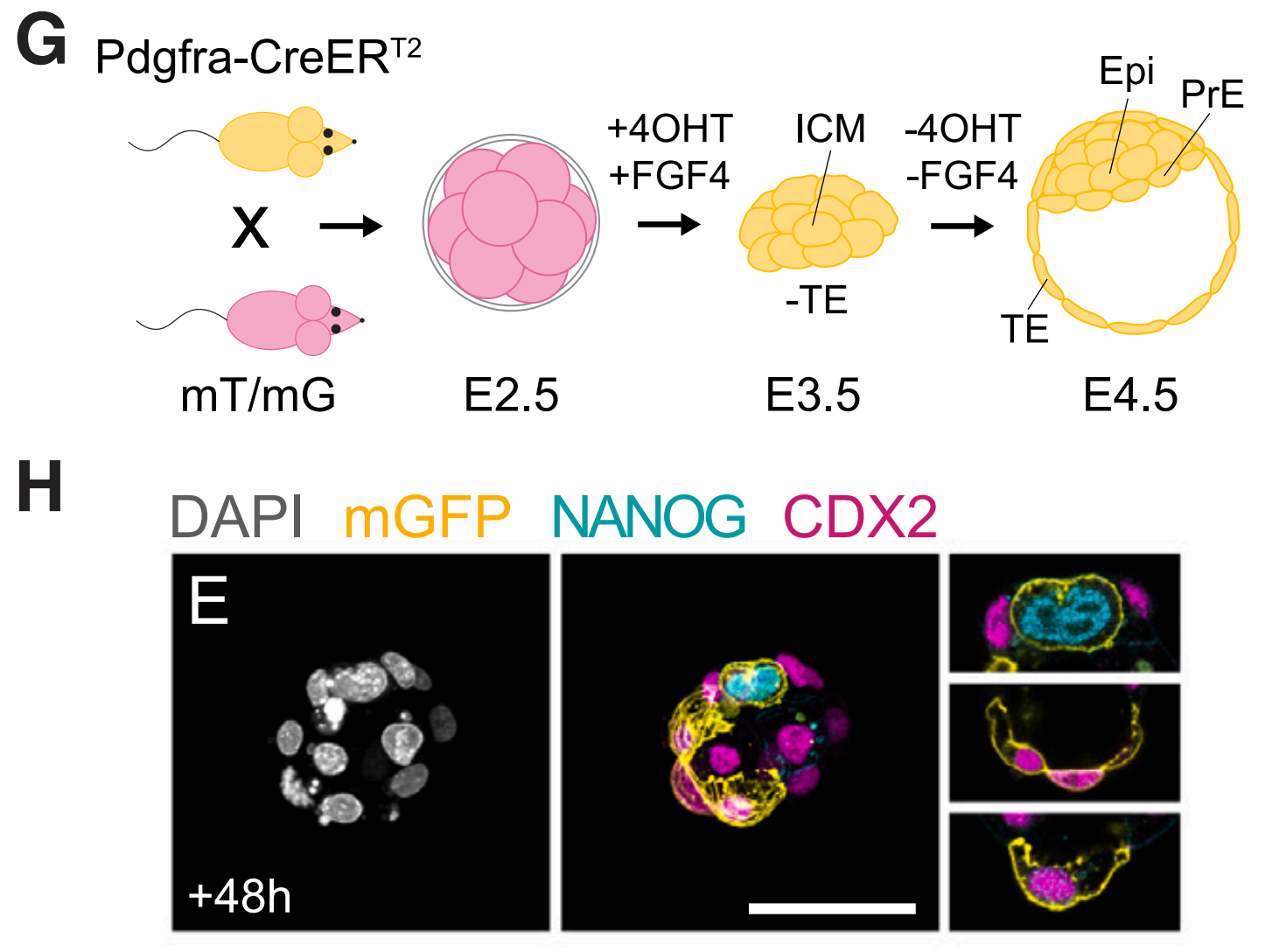
值得一提的是,囊胚的形成伴隨著成纖維細(xì)胞生長(zhǎng)因子和細(xì)胞外信號(hào)調(diào)節(jié)激酶(FGF/ERK)介導(dǎo)內(nèi)細(xì)胞團(tuán)(ICM)細(xì)胞向外胚層(Epi)的分化�,外胚層產(chǎn)生胚胎本身或胚外原始內(nèi)胚層(PrE,也稱(chēng)為下胚層)�,后者隨后形成頂胚層(PE)和內(nèi)臟內(nèi)胚層(VE)。
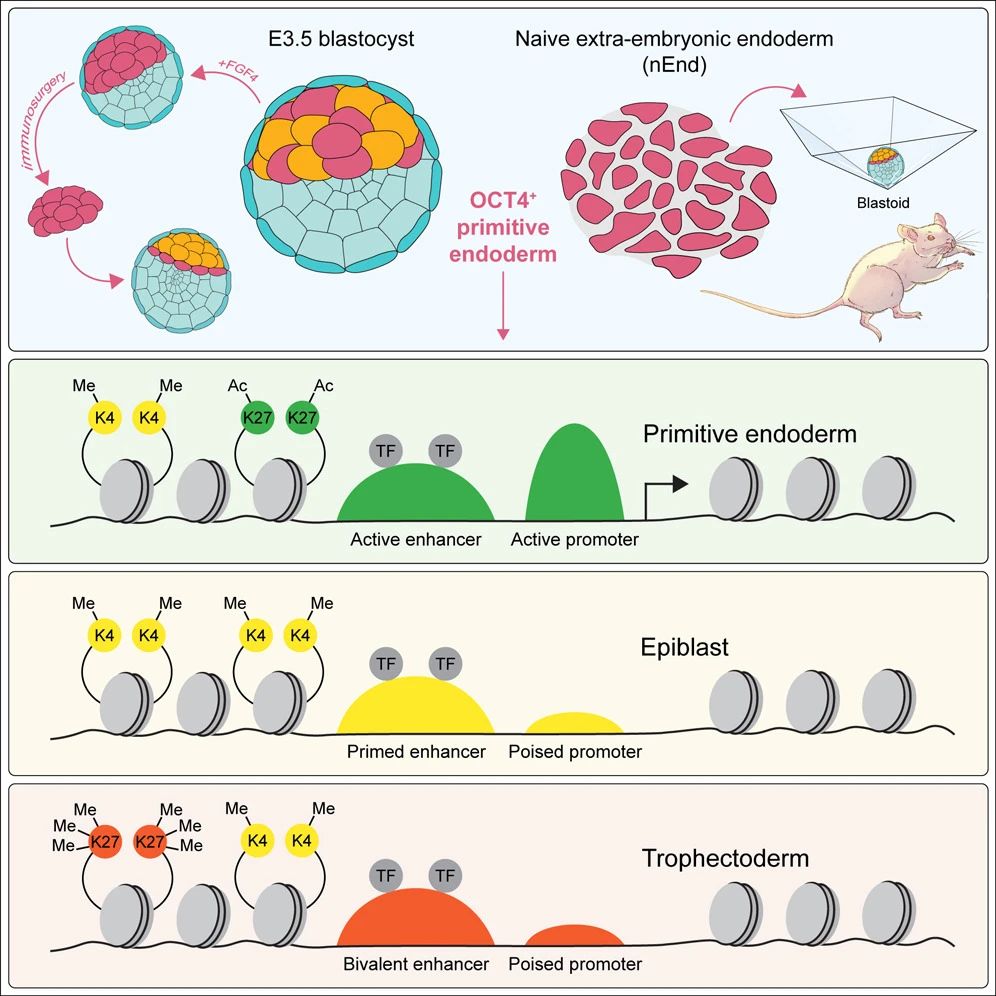
在這項(xiàng)最新研究中��,研究團(tuán)隊(duì)將研究重點(diǎn)聚焦于原始內(nèi)胚層���,這些細(xì)胞通常只能為正常胚胎提供營(yíng)養(yǎng)和支持�,屬于輔助胚胎生長(zhǎng)的“外圍細(xì)胞”�。然而,研究團(tuán)隊(duì)驚訝地發(fā)現(xiàn)���,當(dāng)他們將來(lái)自小鼠胚胎中的原始內(nèi)胚層的干細(xì)胞分離出來(lái)并在培養(yǎng)皿中單獨(dú)培養(yǎng)時(shí)�,這些細(xì)胞以非常高的效率形成“胚芽樣”的重組胚胎��。
E3.5 PrE在擾動(dòng)后具有重建胚胎和胚胎外譜系的能力
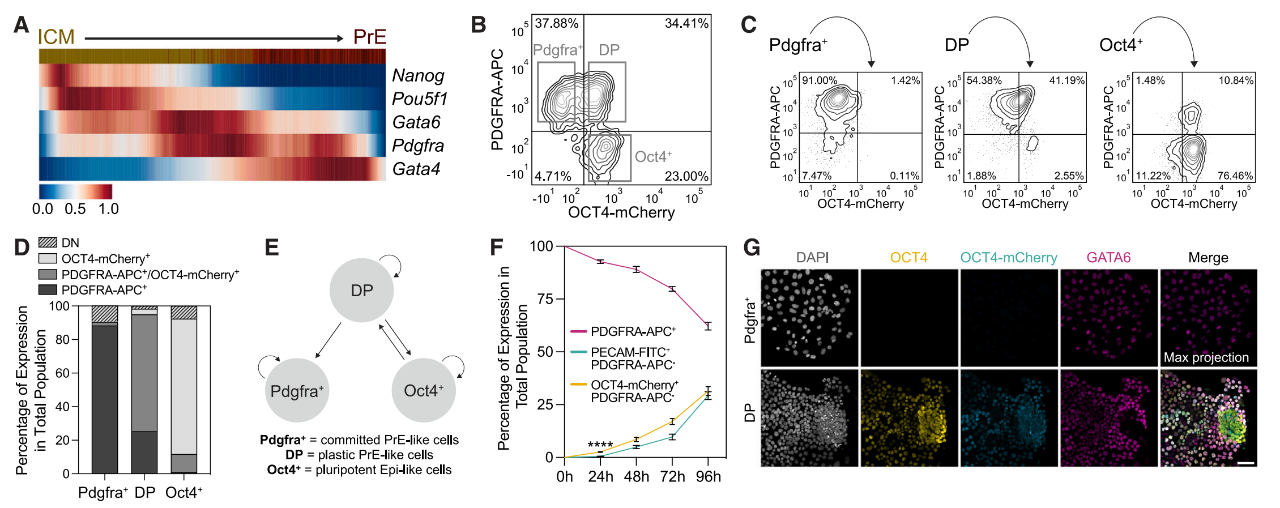
原始內(nèi)胚層保持比外胚層更長(zhǎng)的可塑性窗口期�,并且在正常發(fā)育過(guò)程中,可以觀察到原始內(nèi)胚層向外胚層轉(zhuǎn)換的細(xì)胞命運(yùn)改變�����。原始內(nèi)胚層干細(xì)胞來(lái)源于初始胚胎干細(xì)胞(ESC),可以在LIF����、Wnt和TGF-β信號(hào)的支持下擴(kuò)增為初始胚外內(nèi)胚層(nEnd)。
研究團(tuán)隊(duì)使用nEnd在體外重現(xiàn)了這種可塑性�,并證明了在nEnd中表達(dá)OCT4的細(xì)胞群在體外單獨(dú)培養(yǎng)的情況下有能力形成外胚層(Epi)和滋養(yǎng)外胚層(TE),進(jìn)而生成一個(gè)重組胚胎模型�����。
表達(dá)OCT4的nEnd細(xì)胞群有能力分化成外胚層(Epi)和滋養(yǎng)外胚層(TE)
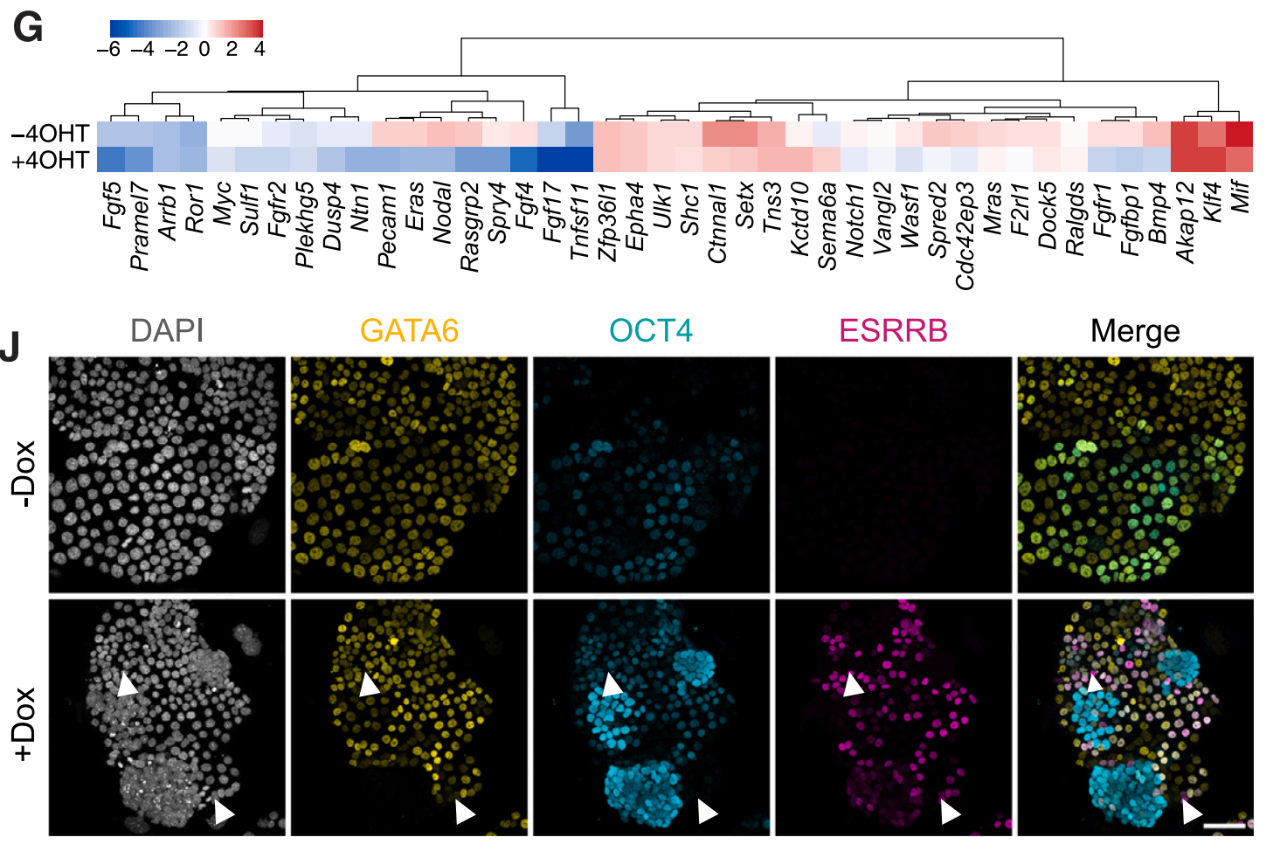
進(jìn)一步研究表明�,原始內(nèi)胚層的可塑性由被JAK/STAT信號(hào)����、OCT4和一組多能性相關(guān)轉(zhuǎn)錄因子的持續(xù)表達(dá)所抑制,這些轉(zhuǎn)錄因子保護(hù)了一個(gè)有利于多譜系分化的增強(qiáng)子景觀�。其中,OCT4是這一過(guò)程的關(guān)鍵�����,這一細(xì)胞因子正是著名的誘導(dǎo)iPSC的“山中因子”之一��,它不僅可以支持細(xì)胞多能性,還處于控制可塑性的基因調(diào)控網(wǎng)絡(luò)的中心���。
“山中因子”是由諾獎(jiǎng)得主山中伸彌發(fā)現(xiàn)的一組轉(zhuǎn)錄因子�����,包括OCT4�、SOX2����、KIF4和cMyc,這些因子能夠誘導(dǎo)細(xì)胞重編程為iPSC���。
OCT4調(diào)控nEnd的可塑性
論文通訊作者 Joshua Brickman 教授表示����,囊胚發(fā)育的最后一步是形成原始內(nèi)胚層�,原始內(nèi)胚層會(huì)以某種方式“記住”如何創(chuàng)造一個(gè)完整的胚胎,如果把原始內(nèi)胚層分離出來(lái)�����,那么它就會(huì)自己生成一個(gè)新的胚胎�����。
研究模式圖
總的來(lái)說(shuō),該研究發(fā)現(xiàn)了一種原本用于輔助胚胎發(fā)育的細(xì)胞群——原始內(nèi)胚層�����,將其分離后單獨(dú)培養(yǎng)�,可以自行生成“胚芽樣”的重組胚胎,并揭示了其背后的分子機(jī)制�����。這些發(fā)現(xiàn)表明��,原始內(nèi)胚層缺陷可能是導(dǎo)致女性懷孕困難的原因之一���,因?yàn)樗粌H為胚胎發(fā)育提供營(yíng)養(yǎng)支持,還可能在修復(fù)發(fā)育損傷方面發(fā)揮重要作用���。這些發(fā)現(xiàn)對(duì)于改善目前對(duì)不孕癥的治療可能特別重要����,并啟示全新生育療法的開(kāi)發(fā)���,










![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博華國(guó)際展覽有限公司版權(quán)所有(保留一切權(quán)利)
滬ICP備05034851號(hào)-57
2006-2024 上海博華國(guó)際展覽有限公司版權(quán)所有(保留一切權(quán)利)
滬ICP備05034851號(hào)-57